铜冶金技术以火法冶炼为主。
(1)火法炼铜的工艺流程如下:
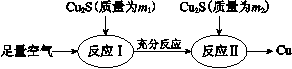
反应Ⅰ:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) ΔH =" -768.2" kJ·mol-1
反应II:2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g) ΔH =" +116.0" kJ·mol-1
①在反应Ⅱ中,每生成1 mol SO2转移电子________mol。
②反应Cu2S(s)+O2(g) =2Cu(s)+SO2(g)的ΔH =________ kJ·mol-1。
③ 理论上m1:m2=________。
(2)炼铜的副产品SO2多用于制硫酸和石膏等化学产品。
①制硫酸中重要的一步反应是
2SO2(g)+O2(g) 2SO3(g) ΔH =" -196" kJ·mol-1。
2SO3(g) ΔH =" -196" kJ·mol-1。
右图表示将2.0 mol SO 2 和1.0 mol O 2 置于1 L密闭容器中,当其他条件一定时,SO2(g)的平衡转化率α随X的变化关系,X(X1、X2)代表压强或温度。
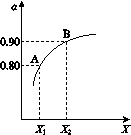
X代表的物理量是________。A对应条件下平衡常数K=________。
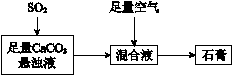
② 下图表示的是生产石膏的简单流程,请用平衡移动原理解释向CaCO3悬浊液中通入SO 2发生反应的原因________。
(3)工业硫酸中往往含有一定量SO 2 ,测定过程如下:取m g工业硫酸配成100 mL溶液,取出20.00 mL溶液,加入1 mL指示剂,用c mol·L-1 I2标准溶液滴定,消耗的I2标准溶液V mL,工业硫酸中含有SO2的质量分数的计算式是________。
相关知识点
推荐试卷