氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高。实验测得,在常温常压下1gH2完全燃烧生成液态水,放出142.9kJ热量。则表示H2燃烧热的热化学方程式为___________ 。
又已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ/mol,则氨在空气中燃烧生成液态水和氮气时的热化学方程式为 。
2NH3(g) ΔH=-92.4kJ/mol,则氨在空气中燃烧生成液态水和氮气时的热化学方程式为 。
(2)氢气是合成氨的重要原料。
①当合成氨反应达到平衡后,改变某一外界条件(不改变 N2、H2和NH3的量),反应速率与时间的关系如下图一所示。
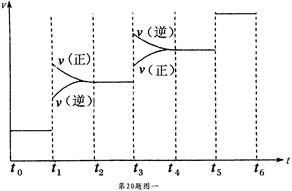
图中t1时引起平衡移动的条件可能是 ,其中表示平衡混合物中NH3的含量最高的一段时间
是 。
②温度为T℃时,将2a molH2和a molN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%。则反应
的平衡常数为 。
③氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对于反应:N2O4(g)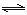 2NO2(g) △H﹥0,在温度为T1、T2时,平衡体系中NO2的体积
2NO2(g) △H﹥0,在温度为T1、T2时,平衡体系中NO2的体积
分数随压强变化曲线如下图二所示。
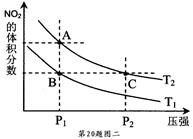
下列说法正确的是 。
a.A、C两点的反应速率:A﹤C
b.A、C两点的气体颜色:A浅,C深
c.B、C两点的气体平均相对分子质量:B﹤C
d.A、C两点的化学平衡常数:A﹥C
e.由状态B到状态A,可以用加热的方法
相关知识点
推荐试卷