(19分)晶体硅是信息科学和能源科学中的一种重要材料,可用于制芯片和太阳能电池等,.以下是工业上制取纯硅的一种方法.

已知:在一定条件下可发生反应:Si(s)+3HCl(g)  SiHCl3(g)+H2(g) ΔH<0
SiHCl3(g)+H2(g) ΔH<0
I.反应②、③均需要加热,有如下两个温度区间分别供两反应选择,你认为反应②应选择_______(填序号字母),原因是_______________;
a .520~530K B.1350~1360K
II.现在实验室模拟工业上粗硅提纯的过程,已知SiHCl3遇水强烈水解,其他相关数据如下表所示:
| 物质 |
SiCl4 |
SiHCl3 |
AlCl3 |
FeCl3 |
| 沸点/℃ |
57.7 |
33.0 |
- |
315 |
| 升华温度/℃ |
- |
- |
180 |
300 |
(1)现用如下装置进行模拟反应②的过程。实验室制HCl的反应原理为:
2NaCl(s) + H2SO4(浓)  2HCl↑ + Na2SO4
2HCl↑ + Na2SO4
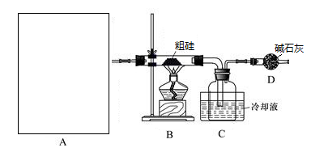
A中是HCl的发生装置,你认为应选择下列哪套装置?____________(填装置的序号字母),装置D中碱石灰的作用为__________________、___________________;
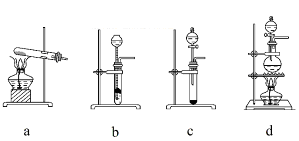
(2)已知液态粗品SiHCl3中含有杂质SiCl4、AlCl3、FeCl3等,则流程中操作①为_____________(填操作名称),下列不是该操作所需的仪器是____________________(填装置序号字母);
a.冷凝管 b. 圆底烧瓶 c. 蒸馏烧瓶 d. 分液漏斗 e.温度计 f. 接受器
(3)用SiHCl3与H2反应制备纯硅的装置如下:

①按图示组装好仪器后,下列实验步骤的正确顺序为____________(填步骤的序号字母),
A.打开甲装置分液漏斗旋塞,滴加稀硫酸,反应生成H2;
B.向装置中添加药品;
C.打开丙装置分液漏斗的旋塞,滴加SiHCl3,并加热相应装置;
D.检查装置气密性;
e.停止向丙装置滴加SiHCl3,并停止加热相应装置;
f.停止通H2;
步骤c中需要加热的装置为____________(填装置序号“甲”、“乙”、“丙”、“丁”)
②该套装置的设计缺陷是________________________。