(16分)氮氧化合物是目前造成大气污染的主要气体。NO在空气中存在如下反应:
2NO(g) + O2(g)  2NO2(g) ΔH
2NO2(g) ΔH
(1)上述反应分两步完成,其中第一步反应①如下,写出第二步反应②的热化学方程式(其反应的焓变ΔH2用含ΔH、ΔH1的式子来表示):
①2NO(g)  N2O2(g) ΔH1<0 ②__________________________
N2O2(g) ΔH1<0 ②__________________________
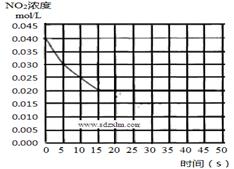
(2)在某温度下的一密闭容器中充入一定量的NO2,测得NO2的浓度随时间的变化曲线如下图所示,前5 秒内的O2的平均生成速率为___________________mol•L-1•s-1,该条件下反应:2NO + O2 2NO2的化学平衡常数数值为_________________,平衡后某时刻,升高反应体系的温度,建立新平衡状态后,测的混合气体的平均相对分子质量小于原平衡状态,则:
2NO2的化学平衡常数数值为_________________,平衡后某时刻,升高反应体系的温度,建立新平衡状态后,测的混合气体的平均相对分子质量小于原平衡状态,则:
2NO(g) + O2(g)  2NO2(g) ΔH______0(填“<”或 “>”);
2NO2(g) ΔH______0(填“<”或 “>”);
(3)2NO(g) + O2(g)  2NO2(g)的两步反应中,反应①的反应速率数值较大,是一个快反应,会快速建立平衡状态,而反应②是一个慢反应,则决定反应2NO(g) + O2(g)
2NO2(g)的两步反应中,反应①的反应速率数值较大,是一个快反应,会快速建立平衡状态,而反应②是一个慢反应,则决定反应2NO(g) + O2(g)  2NO2(g)反应速率的是反应__________(填”①”或“②”)。对(2)中反应体系升高温度的过程中,发现2NO(g) + O2(g)
2NO2(g)反应速率的是反应__________(填”①”或“②”)。对(2)中反应体系升高温度的过程中,发现2NO(g) + O2(g)  2NO2(g)的反应速率变慢,结合该反应的两步反应过程分析可能的原因__________________________(反应未使用催化剂)。
2NO2(g)的反应速率变慢,结合该反应的两步反应过程分析可能的原因__________________________(反应未使用催化剂)。
(4)若(2)中反应体系,反应开始时使用催化剂,请在(2)的图中画出该反应体系反应进程可能的曲线。
(5)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2和O2除去,如右图示,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-,电解池阴极反应为__________________。