某同学为了测定水中氢、氧两元素的质量比,设计了以下实验,实验装置如图。现提供的化学试剂有:铜粉、氧化铜、无水氯化钙、硫酸铜晶体、稀硫酸、稀硝酸、浓硫酸、浓盐酸、锌粒。
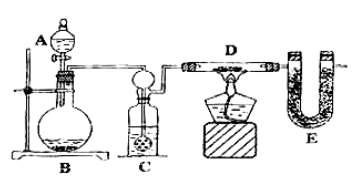
(1)装置D中发生的反应的化学方程式是 ;
(2)装置C中进气管出口为多孔球泡,多孔球泡除导气外,其主要作用是 ;
(3)反应完成后,冷却时,发现玻璃管D中有水珠残留,此时该采用的正确操作是 ;
(4)开始反应前,先称量装置D和装置E的质量,分别依次为W1和W2,反应完成之后,冷却、再称量,质量分别依次为W3和W4。根据以上数据,计算水中氢原子与氧原子的个数比的算式为(用含W1、W2、W3和W4的式子表示): ;
(5)如要求实验更精确,可在装置E后再接一个盛有碱石灰的U形管,此U形管的作用是 ;
(6)若实验测得m(H):m(O)>1:8,关于导致这一结果的原因分析中,一定错误的是 。
| A.装置C中硫酸的浓度不大,作用不太好 |
| B.装置E后缺少干燥装置 |
| C.称量装置D和装置E的质量时,称量值均偏大 |
| D.CuO没有全部被还原 |
推荐试卷