【化学——选修3 物质结构与性质】选考下图为元素周期表的一部分,字母下方数值为该元素电负性,根据信息回答下列问题(用相应元素符号进行答题):
(1)b、h两元素可形成化合物bh2,写出其电子式: 。
(2)e、g两元素可形成两种化合物eg3、e2g6,eg3的分子构型为 ,eg3、e2g6中心原子e的杂化方式分别为 、 。
(3)d元素形成的单质可与g的氢化物浓溶液在加热条件下反应生成一种以二价d离子为内界中心原子(配位数为4)的配位化合物与一种可燃性气体,写出反应的化学方程式: 。
(4)f、g、h、i四种元素对应单质分子的键能如下表:
| 共价键 |
f—f |
g—g |
h—h |
i—i |
| 键能(kJ/mol) |
157 |
242.7 |
193.7 |
152.7 |
试从原子半径角度阐述f—f键键能反常的原因: 。
(5)c元素的元素符号是 ,价电子排布式为 ,下图是
一种受到较多关注的c元素单质与金属镧(La)形成的储氢材料的结构示意图,请在图中勾画出该晶体的一个晶胞。计算出该合金的化学式为: 。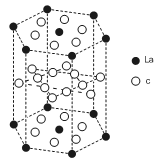
相关知识点
推荐试卷