某研究性小组探究乙酸乙酯的反应机理,实验如下:已知:相关物理性质(常温常压)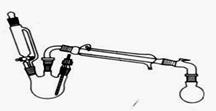
| |
密度g/mL |
熔点/℃ |
沸点/℃ |
水溶性 |
| 乙醇 |
0.79 |
-114 |
78 |
溶 |
| 乙酸 |
1.049 |
16.2 |
117 |
溶 |
| 乙酸乙酯 |
0.902 |
−84 |
76.5 |
不溶 |
合成反应:在三颈烧瓶中加入乙醇5mL,硫酸5mL,2小片碎瓷片。漏斗加入乙酸14.3 mL,乙醇20 mL。冷凝管中通入冷却水后,开始缓慢加热,控制滴加速度等于蒸馏速度,反应温度不超过120 ℃。分离提纯:将反应粗产物倒入分液漏斗中,依次用少量饱和的Na2CO3溶液、饱和NaCl溶液、饱和CaCl2溶液洗涤,分离后加入无水碳酸钾,静置一段时间后弃去碳酸钾。最终通过蒸馏得到纯净的乙酸乙酯。
回答下列问题:
(1)制取乙酸乙酯化学方程式为:_____________ _______。
(2)浓硫酸与乙醇如何混合? 。
(3)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是_______(填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是? 。
(5)蒸出的粗乙酸乙酯中主要有哪些杂质? 。
(6)饱和的Na2CO3溶液洗涤除去乙酸,能否换成NaOH溶液?若不能,为什么?(用化学方程式表示) ; 。
用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,为什么不用水? 。