甲醇是一种重要的化工原料。甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景。现有如下实验,在体积为1 L的密闭容器中,充入1mol CH3OH和1molH2O,一定条件下发生反应:CH3OH (g)+ H2O (g) CO2(g) +3 H2 (g),测得CO2和CH3OH(g)的浓度随时间变化如下表所示。
CO2(g) +3 H2 (g),测得CO2和CH3OH(g)的浓度随时间变化如下表所示。
| 时间 物质 |
0 min |
10 min |
30 min |
60 min |
70 min |
| CO2(mol/L) |
0 |
0.2 |
0.6 |
0.8 |
0.8 |
| CH3OH(mol/L) |
1.0 |
0.8 |
0.4 |
0.2 |
0.2 |
①已知:CH3OH (g)+ 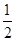 O2 (g)
O2 (g) CO2(g) + 2H2 (g) H1= —192.9kJ/mol
CO2(g) + 2H2 (g) H1= —192.9kJ/mol
H2(g)+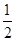 O2 (g)
O2 (g) H2 O(g) H2= —120.9kJ/mol
H2 O(g) H2= —120.9kJ/mol
则甲醇与水蒸气催化重整反应的焓变△H3=_____ 。
②10~30 min内,氢气的平均反应速率v(H2)=___________mol/(L·min)。
③该反应的平衡常数表达式为K=__________________。
④下列措施中能使平衡时n(CH3OH)/n(CO2)减小的是(双选)___________。
A.加入催化剂 B.恒容充入He(g),使体系压强增大
C.将H2(g)从体系中分离 D.再充入1molH2O
(2)甲醇在催化剂条件下可以直接氧化成甲酸。
①在常温下,用0.1000 mol/L NaOH溶液滴定20. 00 mL 0.1000 mol/L 甲酸溶液过程中,当混合液的pH=7时,所消耗的V(NaOH)___(填“<”或“>”或“=”) 20. 00 mL。
②在上述滴定操作中,若将甲酸换成盐酸,请在图中的相应位置画出相应的滴定曲线。(1滴溶液约0.04mL) 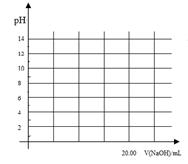
相关知识点
推荐试卷